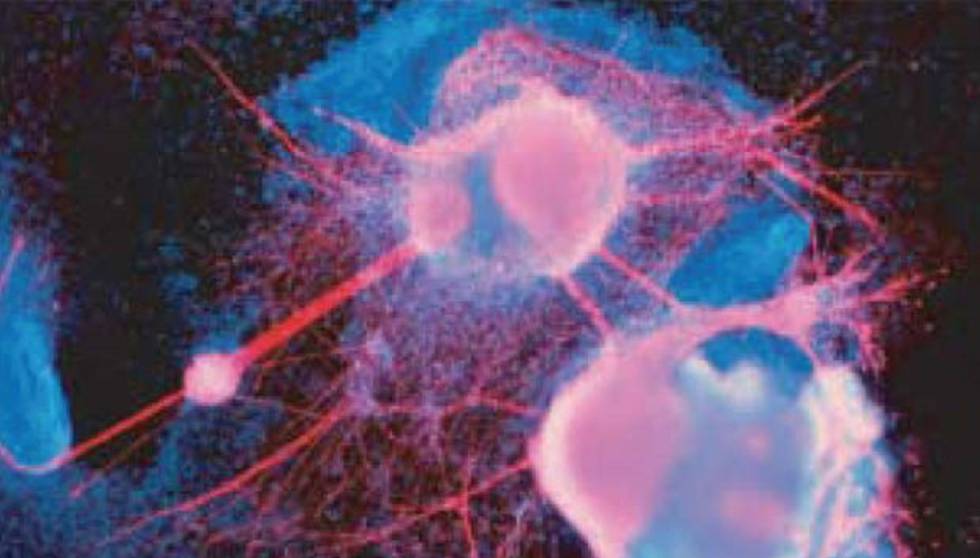
os miniscopios, diminutos microscopios de fluorescencia que se colocan en la cabeza de los animales, ofrecen una imagen clara de su actividad neuronal mientras exploran e interaccionan con el entorno. La técnica ha sido declarada método del año 2018 para la investigación biológica.
Los ratones de Catherine Dulac, neurobióloga de Harvard, se comportan de acuerdo con su naturaleza. Husmean sus habitáculos en busca de pistas olfativas que puedan indicarles la presencia de un familiar, un adversario o una posible pareja.
Pero, mientras los animales exploran, el equipo de Dulac monitoriza minuciosamente en ellos determinados circuitos neuronales, y sigue el progreso de su actividad mediante un bloque de instrumentos adherido al cráneo. El dispositivo, un microscopio de fluorescencia en miniatura acoplado a una lente y a una fina sonda endoscópica que se introduce en el cerebro, se ha revelado como una herramienta liberadora para los neurocientíficos, que ahora empiezan a poder relacionar la actividad neuronal con el comportamiento en el mundo real. «Las conductas sociales, por definición, se manifiestan cuando un individuo se mueve e interactúa con otros», explica Dulac. «La nueva técnica resulta clave para captar la actividad cerebral cuando un animal realiza una tarea que uno estudia.»
Los investigadores que trabajan con roedores disponen desde hace casi veinte años de métodos para obtener imágenes in vivo de la actividad cerebral en animales despiertos. Pero estas técnicas al principio requerían inmovilizar la cabeza para conseguir una detección estable por fluorescencia. Por eficaces que fueran, las restricciones que imponían impedían llevar a cabo muchos estudios de comportamiento. «Mi laboratorio aspiraba a adentrarse en nuevas áreas relacionadas con la exploración espacial y la conducta social», comenta Peyman Golshani, de la Universidad de California en Los Ángeles (UCLA). «Nos resultaba muy difícil adaptarnos a los sistemas que exigían la inmovilización de la cabeza.»
Los rápidos e innovadores avances en el desarrollo de microscopios en miniatura permiten ahora formular preguntas fundamentales sobre el modo en que los circuitos neuronales gobiernan eventos cognitivos, conductuales y fisiológicos complejos, un paso crítico hacia la comprensión de los principios que subyacen a la organización y el funcionamiento del cerebro. Todo ello ha motivado que la técnica haya sido declarada método del año 2018 por la revista Nature Methods.
Impacto profundo
El primer aparato de esas características, un módulo que constaba de un microscopio de fluorescencia de 1,1 gramos conectado a una cámara externa a través de cables de fibra óptica, fue desarrollado en 2008 por el grupo de Mark Schnitzer en la Universidad Stanford. El dispositivo monitorizaba sin interrupción las señales generadas por sensores de calcio codificados genéticamente (un indicador indirecto que suele emplearse para medir potenciales de acción) en subconjuntos escogidos de neuronas.
Este instrumento de primera generación detectó variaciones de la actividad cerebelar en ratones, tanto en reposo como en movimiento, pero solo en un pequeño número de células y con una pobre resolución temporal. El equipo de investigadores ha logrado perfeccionarlo de forma sustancial y lo ha comercializado a través de la empresa Inscopix, con sede en Palo Alto. El trabajo de Schnitzer atrajo la atención de numerosos científicos, entre ellos Golshani, quien quedó impresionado por sus posibilidades. Sin embargo, carecía de los recursos suficientes para comprar este elemento de hardware, que era bastante caro. Junto con sus colaboradores de la UCLA Alcino Silva, Bhaljit Khakh y Daniel Aharoni, creó una versión casera de código abierto del dispositivo de Schnitzer. «Terminó costándonos unos de 1000 dólares», recuerda Golshani. Su grupo ha colgado gratuitamente en Internet los diseños de su «miniscopio», así como el software asociado (www.miniscope.org). Mientras tanto, la plataforma no ha dejado de evolucionar y se ha convertido en una popular alternativa para los laboratorios que quieran ajustar o modificar las capacidades de sus microscopios en miniatura.
Antes de la aparición de estos dispositivos, los investigadores que estudiaban el cerebro durante la vigilia contaban con dos opciones principales. Podían obtener imágenes de alta resolución de neuronas individuales realizando una microscopía de excitación de dos fotones a través de una «ventana» en el cráneo de un animal inmovilizado. O bien, podían emplear técnicas de fotometría, en las que insertaban sondas de fibra óptica en el cerebro para monitorizar la fluorescencia asociada al calcio en una determinada región del tejido neuronal mientras el animal merodeaba sin impedimentos. Sin embargo, ambos métodos presentan limitaciones. «La microscopía bifotónica transformó el campo, pero en la mayoría de los casos el comportamiento se ve restringido por la sujeción de la cabeza», comenta Anatol Kreitzer, de la Universidad de California en San Francisco. «Con la fotometría de fibra, el animal se mueve con plena libertad, pero no se consigue una buena resolución celular.»
Los microscopios que, a modo de casco, se colocan en la cabeza, presentan numerosas ventajas. Por un lado, pueden captar imágenes de casi cualquier región del cerebro. Suelen utilizarse lentes de gradiente de índice con forma de varilla que se implantan quirúrgicamente en el sitio deseado antes de conectarla al microscopio en miniatura, lo cual permite obtener imágenes claras de tejidos que de otro modo serían inaccesibles. «En teoría, podría visualizarse cualquier región del cerebro; de hecho, ya se han alcanzado estructuras profundas, como la amígdala y el hipotálamo», comenta Da-Ting Lin, del Instituto Nacional sobre Drogadicción de EE.UU. Este logro reviste especial importancia porque muchas estructuras relacionadas con el comportamiento animal residen muy por debajo de la superficie de la corteza. Una vez que se implanta la lente y se instala el microscopio, pueden observarse grandes cantidades de células durante períodos prolongados. «Estamos obteniendo imágenes de unas 200 neuronas en un momento dado, y lo hacemos con todos nuestros ratones durante varios meses», afirma Dulac.
Lectores de mente
La ventaja esencial de los microscopios colocados en el cráneo estriba en que, cuando los animales se liberan de su sujeción, resulta mucho más probable que se conduzcan con normalidad. Los experimentos en los que se inmoviliza la cabeza compensan esta restricción mediante el uso de herramientas de realidad virtual o de juegos de bolas, las cuales permiten a los ratones interactuar con su entorno. No obstante, este tipo de estrategias requieren un entrenamiento adicional y no siempre logran recoger por completo el comportamiento en el mundo real. En cambio, los microscopios en miniatura permiten llevar a cabo pruebas y diseños experimentales ampliamente contrastados en roedores. «Utilizamos lo que otras personas consideran paradigmas del comportamiento animal», explica Lin.
El equipo de Lin ha investigado la función motora en ratones usando el miniscopio centrándose en los circuitos neuronales que controlan el inicio y el final del movimiento. El neurocientífico subraya que, aunque en un principio la información relacionada con el movimiento se comunica a los ganglios basales a través de millones de neuronas, las señales de salida de esta estructura cerebral se transmiten posteriormente a través de un número bastante inferior, del orden de unas decenas de miles. Ello sugiere que, por el camino, o bien se descarta información, o bien se codifica de un modo más eficiente. Lin y sus colaboradores abordaron dicha cuestión al obtener imágenes de subconjuntos de neuronas del cuerpo estriado en ratones que se movían con total libertad, y luego relacionaron los datos con la tipología de los impulsos eléctricos. «Identificamos agrupamientos neuronales cuya actividad codifica información relevante para la locomoción», indica. «Podríamos incluso usar esta actividad para predecir la velocidad del movimiento.»
Como ha demostrado Dulac, esta también constituye una excelente herramienta para analizar comportamientos sociales. Su equipo empleó el instrumento de Inscopix para identificar las neuronas en la amígdala media, una estructura situada en el cerebro profundo, las cuales se iluminan como respuesta a los estímulos olfativos asociados con crías jóvenes, ratones del sexo opuesto o depredadores. En un principio esperaba encontrar subconjuntos de células bien definidos que reaccionaran selectivamente a los distintos desencadenantes, pero, en su lugar, descubrió una complejidad y flexibilidad asombrosas en el modo en que se representa esta información. «La actividad de una población de neuronas proporciona la codificación precisa del estímulo concreto al que estuvo expuesto el animal. Además, advertimos diferencias entre machos y hembras», señala Dulac. Sorprendentemente, esas tendencias se veían acentuadas por las experiencias vitales; en especial, el apareamiento parecía agudizar las facultades discriminatorias. «Tras la cópula, los animales ven el mundo de modo muy distinto y continúan así durante mucho tiempo», afirma la neurobióloga. «Aunque debería decir “huelen” en lugar de “ven”.» Un estudio de estas características, que depende de la monitorización prolongada de comportamientos complejos, habría sido inviable con los procedimientos que requieren la sujeción de la cabeza.

Fuentes: de O. Skocek et al. en Nat. Methods vol. 15, págs. 429–432, 2018, Springer Nature (ratón); de K. K. Ghosh et al. en Nat. Methods vol. 8, págs. 871–878, 2011, Springer Nature (Corte transversal del microscopio); de J. G. Parker et al. en Nature vol. 557, págs. 177–182, 2018, Springer Nature (miniscopio acoplado).
Asimismo, resulta beneficioso que los animales deambulen con libertad en los estudios sobre memoria y aprendizaje, que a menudo examinan las interacciones con entornos familiares y desconocidos. En la primera demostración publicada del miniscopio, el equipo de la UCLA utilizó el instrumento para demostrar una teoría sobre la codificación de la memoria que Silva había elaborado años atrás. «Se trata de un modelo muy específico que describe cómo vinculamos los recuerdos en el tiempo», explica. «La idea es que, cuando entra un recuerdo, se incorpora a un grupo de células que se activan con más facilidad durante un cierto período.» Ello permitiría al cerebro establecer conexiones sólidas entre sucesos que guardan una relación estrecha y reducir las probabilidades de que se construyan falsas asociaciones. Con la obtención de imágenes de las células responsables de la memoria espacial en el hipocampo de ratones, Silva dotó de un soporte experimental a este modelo y demostró que los sucesos que ocurren en una sucesión más o menos rápida —en este caso, los cambios producidos en el entorno de la jaula y un estímulo inductor de miedo— se codifican con más fuerza y con una mayor superposición en el cerebro que los sucesos separados en el tiempo.
A primera vista, cabría suponer que el sueño podría estudiarse igual en un animal casi inmóvil que en uno sin ataduras, pero Yang Dan, de la Universidad de California en Berkeley, considera que este último constituye un mejor modelo para investigar la regulación del sueño y la vigilia. «Los ratones duermen mucho mejor y de forma más natural si gozan de libertad», afirma la neurocientífica. «Cuando se sujetan, necesitan mucho tiempo para habituarse.» Mediante miniscopios, su equipo ha empezado a trazar mapas de los circuitos neuronales que incitan el sueño frente a aquellos que inducen la vigilia; también los han empleado para distinguir las poblaciones de células que facilitan la transición entre las fases de sueño MOR y no MOR. Dan señala que estos distintos tipos de células a menudo se entrelazan en una determinada región cerebral, lo cual desbarató los anteriores intentos de diseccionar los circuitos del sueño. «Con las nuevas imágenes, puede observarse un montón de neuronas del mismo animal simultáneamente, por lo que resulta más sencillo hacerse una idea de su distribución espacial», concluye.

Reimpreso con permiso de Y. Ziv et al. en Nat. Neurosci., vol 16, págs. 264-266, 2013; Springer Nature.
Comunicaciones interrumpidas
La posibilidad de identificar los circuitos responsables del funcionamiento normal del cerebro también brinda a los investigadores un apoyo para entender qué falla en los trastornos neurológicos. «Siempre que haya un mecanismo complejo que resulte crítico y fundamental para la función cerebral, también existirá una dolencia asociada a él», sentencia Silva.
Los análisis efectuados por su equipo sobre la codificación de la memoria ya han aportado varias ideas sobre cómo el cerebro pierde la capacidad de almacenar información nueva con la edad. De esta manera, los ratones más viejos que se sometieron a la misma prueba de memoria descrita arriba no lograron establecer las sólidas asociaciones entre una determinada disposición de la jaula y la subsiguiente descarga en las patas, mientras que estas sí se formaban inmediatamente en los circuitos neuronales de sus homólogos más jóvenes. Del mismo modo, podría resultar relevante para comprender enfermedades como la demencia senil, o incluso la esquizofrenia. «Se sabe que las personas esquizofrénicas hacen asociaciones anómalas», apunta Silva. «Sospecho que los mecanismos que vinculan los recuerdos entre sí se interrumpen no solo al envejecer, sino probablemente también en los trastornos psiquiátricos.»
En ese sentido, los miniscopios también facilitan las investigaciones sobre enfermedades relacionadas con el movimiento, como el párkinson, para el que se conocen bien las estructuras cerebrales alteradas pero no la naturaleza de su disfunción. Recientemente, Schnitzer y sus colaboradores han estudiado cómo contribuyen a los síntomas de dicho trastorno dos importantes circuitos neuronales en los ganglios basales, las denominadas vías «directa» e «indirecta». Estas dos vías se contraponen para promover o inhibir el movimiento, y desde hace tiempo se baraja la hipótesis de que el deterioro que produce la enfermedad surge de un desequilibrio en la actividad de los dos circuitos debido a la pérdida gradual de las neuronas dopaminérgicas. Tras observar ambas vías en ratones y examinar sus respuestas a diferentes dosis de levodopa (el tratamiento clínico estándar), el grupo de Schnitzer dibujó un panorama más complejo. Sus hallazgos no solo confirmaban algunos aspectos del modelo existente del párkinson y aportaban nuevos detalles sobre el mecanismo de acción del tratamiento con levodopa, sino que también revelaban patrones de actividad inesperados en los dos conjuntos de neuronas. «Ello nos permitió verificar algunas ideas propuestas tiempo atrás sobre dos poblaciones entrelazadas de neuronas, las cuales no pueden diferenciarse bien con electrodos extracelulares», explica Schnitzer. Además, sus hallazgos podrían guiar la búsqueda de tratamientos de continuidad para la levodopa, que a largo plazo pierde eficacia y produce efectos secundarios motores.
En términos más generales, la posibilidad de llevar a cabo experimentos exhaustivos de neurociencia funcional en roedores podría reforzar su utilidad como modelo para trastornos neurológicos y psiquiátricos en humanos —una rehabilitación que debería haberse acometido hace tiempo, en opinión de Silva—. «Hemos acumulado una ingente cantidad de información concluyente sobre el funcionamiento del cerebro, pero, como comunidad, a menudo hemos fallado a la hora de convertir todo este conocimiento en tratamientos», explica, y añade que buena parte de la culpa ha recaído injustamente sobre los diminutos hombros de los ratones. «Se arguye que son muy diferentes de los humanos y que no sirven para predecir con suficiente certeza si algo funcionará.» En fecha reciente, y para refutar estos argumentos, Silva y sus colaboradores han analizado los 40 medicamentos neuropsiquiátricos más vendidos y han descubierto que todos provocaban algún efecto en la conducta de los roedores.
Los modelos murinos de comportamiento nunca reflejarán a la perfección las complejas expresiones cognitivas que se perciben en los humanos, pero la capacidad de dirigirse directamente a los circuitos neuronales afectados y monitorizar su actividad podría tener un valor incalculable en la búsqueda de tratamientos más eficaces a la hora de atacar la raíz de un trastorno específico. «Es posible que estas señales dinámicas de la red proporcionen un biomarcador que se manifieste antes de que el animal muestre alteraciones funcionales», sugiere Golshani, que en la actualidad utiliza el miniscopio para evaluar modelos de autismo y epilepsia en ratones.
Y para cuestiones neurológicas cuya complejidad impide su exploración en roedores, un equipo de la Universidad de Keio liderado por Hideyuki Okano y Junichi Ushiba ha demostrado hace poco la viabilidad del instrumento de Inscopix para estudiar el comportamiento de titis despiertos. «Existen buenas razones para creer que se convertirá en una herramienta importante para entender las señales de circuitos neuronales en cerebros sanos y enfermos», afirma Schnitzer, que colaboró en el
experimento piloto.
experimento piloto.
Una imagen más nítida
El nuevo dispositivo se ha beneficiado de la existencia de herramientas robustas: los sensores de calcio fluorescentes, en particular una familia de proteínas diseñadas por bioingeniería conocidas como GCaMP, que los científicos del Campus de Investigación Janelia han ido perfeccionando a lo largo de los últimos diez años. «Son magníficas, y no dejan de mejorar», comenta Kreitzer, pese a que también advierte que «hay que admitir no se observa directamente la actividad neuronal». Esto no supone por necesidad un problema, ya que, por lo general, se establece una buena correlación entre las señales generadas y la activación del circuito neural. El equipo de Kreitzer ha llegado a utilizar imágenes in vivo de la actividad de GCaMP en el cerebro del ratón para caracterizar el modo en que las variaciones en los niveles de calcio neuronal contribuyen a la memoria y al aprendizaje, aparte del arraigado papel que desempeña en el inicio del impulso eléctrico.
No obstante, también ha despertado un entusiasmo considerable el desarrollo de sensores codificados genéticamente que se activan en respuesta a un cambio de voltaje en las células, lo cual proporcionaría lecturas mucho más inmediatas y precisas de los impulsos neuronales, aunque la generación actual de sensores exigirá un esfuerzo paralelo nada desdeñable en el diseño de hardware. «Necesitan mucha luz y cámaras sumamente rápidas», apunta Kreitzer. Varios grupos también trabajan con indicadores fluorescentes que se iluminan en presencia de neurotransmisores específicos, como la dopamina, lo cual otorgaría acceso a una comprensión más profunda de la actividad cerebral.
Por otra parte, los desarrolladores de miniscopios también se afanan en aumentar la cantidad y la calidad de los datos recogidos. Golshani ha colaborado con el investigador de la Universidad Rockefeller Alipasha Vaziri para construir un microscopio de campo de luz que genere imágenes de la actividad eléctrica de secciones tridimensionales que contienen más de 800 neuronas en animales que se comportan libremente, lo cual supone una notable mejora con respecto a las imágenes bidimensionales, de un plano, que se obtienen con los instrumentos clásicos de un solo fotón. «Nos gustaría comparar frente a frente las capas superficiales y profundas del hipocampo y ver si sus propiedades de respuesta difieren», explica Golshani. En paralelo, un grupo de la Universidad de Pekín ha demostrado que es posible realizar microscopía bifotónica con un microscopio portátil, lo que da lugar a imágenes tridimensionales nítidas y de alta resolución que en el pasado solo podían conseguirse mediante la sujeción de la cabeza.
Sin embargo, tal vez lo que mayor entusiasmo suscite provenga de la posibilidad de combinar esta técnica con la optogenética [véase «Control del cerebro por medio de la luz», por Karl Deisseroth; Investigación y Ciencia, enero de 2011], elegida método del año 2010, con el fin de manipular determinados circuitos cerebrales escogidos a la vez que se observan las consecuencias funcionales directas. Tanto la comunidad interesada en el miniscopio como la empresa Inscopix han creado instrumentos que permitirían la estimulación dirigida y simultánea con la captación de imágenes. «Ahora no solo puede percibirse el efecto de una manipulación sobre el comportamiento o la actividad bruta en una región del cerebro, sino también la actividad en un tipo específico de células», comenta Kreitzer, uno de los primeros usuarios del instrumento de Inscopix (y miembro del comité asesor científico de la empresa). «Creo que ese es su verdadero poder.»
En conjunto, la rápida evolución de esta técnica anuncia una nueva forma de enfocar la neurociencia desde una perspectiva funcional integrada, a nivel de sistema, en lugar de abordarla con los métodos conductuales macroscópicos o las estrategias moleculares y celulares microscópicas que predominan en la actualidad. En opinión de Silva, el objetivo radica nada más que en vislumbrar el «código fuente» del cerebro. «Tras la complejidad del universo, existen leyes muy sencillas, como “F = ma”», asegura. «En biología hemos de descubrirlas y conectarlas con los principios de ingeniería que lo unieron todo.»